ESTRUCTURA ATÓMICA
La estructura de un material puede ser examinada en cuatro niveles: estructura atómica, arreglo de los átomos, micro-estructura y macro-estructura.
La estructura atómica influye en la forma en que los átomos se unen entre si.
1.1 ESTRUCTURA DEL ÁTOMO

Un átomo esta compuesto de un núcleo rodeado por electrones. El núcleo contiene neutros y protones de carga positiva y carga positiva neta. Los electrones de carga negativa, están sujetos al núcleo por atracción electrostática.
1.2 ESTRUCTURA ELECTRÓNICA DEL ÁTOMO
Los electrones ocupan niveles de energía discontinuos dentro del átomo. Cada electrón posee una energía en particular, no existen mas de dos electrones en cada átomo con una misma energía. Esto también implica que existe una diferencie de energía discreta entre cualesquiera.
Números cuánticos: El nivel de energía al cual corresponde cada electrón queda determinado por cuatro números cuánticos. El numero de niveles de energía posibles es determinado por los tres primeros números cuánticos.
1.3 ENLACES ATÓMICOS
ENLACE METÁLICO

Un enlace metálico es un enlace químico que mantiene unidos los átomos (unión entre núcleos atómicos y los electrones de valencia, que se juntan alrededor de éstos como una nube) de los metales entre sí.
Estos átomos se agrupan de forma muy cercana unos a otros, lo que produce estructuras muy compactas. Se trata de líneas ridimensionales que adquieren estructuras tales como: la típica de empaquetamiento compacto de esferas (hexagonal compacta), cúbica centrada en las caras o la cúbica centrada en el cuerpo.
ENLACE COVALENTE

Un enlace covalente entre dos átomos se produce cuando estos átomos se unen, para alcanzar el octeto estable, compartiendo ectrones del último nivel1 (excepto el Hidrógeno que alcanza la estabilidad cuando tiene 2 electrones). La diferencia de electronegativo entre los átomos no es lo suficientemente grande como para que se produzca una unión de tipo iónica. Para que un enlace covalente se genere es necesario que la diferencia de electronegatidad entre átomos sea menor a 1,7.
ENLACE IONICO
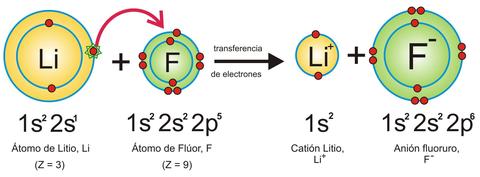
es la unión de átomos que resulta de la presencia de atracción electrostática entre los iones de distinto signo, es decir, uno fuertemente electropositivo (baja energía de ionización) y otro fuertemente electronegativo (alta finidad electrónica). Eso se da cuando en el enlace, uno de los átomos capta electrones del otro. La atracción electrostática entre los iones de carga opuesta causa que se unan y formen un compuesto químico simple, aquí no se fusionan; sino que uno da y otro recibe. Para que un enlace iónico se genere es necesario que la diferencia (delta) de electronegativos sea más que 1,7.
ENLACE MIXTO
En la mayor parte de los materiales, el enlace entre átomos es una mezcla de dos o mas tipos.
ENLACE DE VAN DER WALS
Unen moléculas o grupos de átomos mediante una atracción electrostática débil.
1.4 ENERGÍA DE ENLACES Y ESPACIO INTERATOMICO
La distancia de equilibrio entre átomos se debe a un equilibrio entre fuerzas de repulsion y de atracción. En el caso del enlace metálico, por ejemplo la atracción entre electrones y cuerpo centrales, atómicos es correspondiente por la repulsión entre las moléculas de los átomos.
No hay comentarios:
Publicar un comentario