ORGANIZACIÓN ATÓMICA
Estructura de los átomos
Los átomos están
constituidos de trespartículas subatómicas:protones, neutronesyelectrones.El
modelo más simple:núcleo(10exp-14 m de diámetro)nube de electrones poco
dispersa y dedensidad variable(10exp-10 m de diámetro)
El núcleo toda la masa del átomo
La nube de electrones todo elvolumen
del átomo
Los electrones, particularmente
los más externos, determinan la mayor parte de las propiedades
eléctricas,mecánicas, químicas y térmicas de los
átomos”
NIVELES DE ORDENAMIENTO ATOMICO
En este ejercicio de estructura atómica determinaremos, en primer lugar, los
números cuánticos que corresponden a una serie de
orbitales atómicos. Recordemos que un orbital atómico queda perfectamente definido con los tres primeros números cuánticos, n, l y m, ya que el cuarto número cuántico, s, define el electrón. Esto puedes repasarlo en la
teoría de orbitales atómicos y números cuánticos
Una vez determinados los números cuánticos, usaremos el diagrama de Moeller para ordenar dichos orbitales de menor a mayor energía:
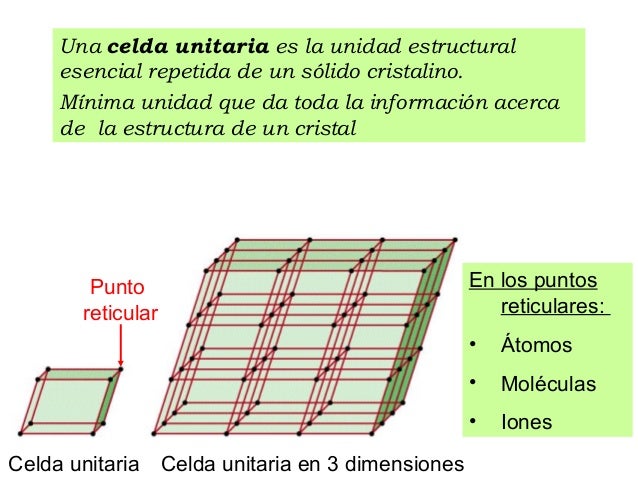
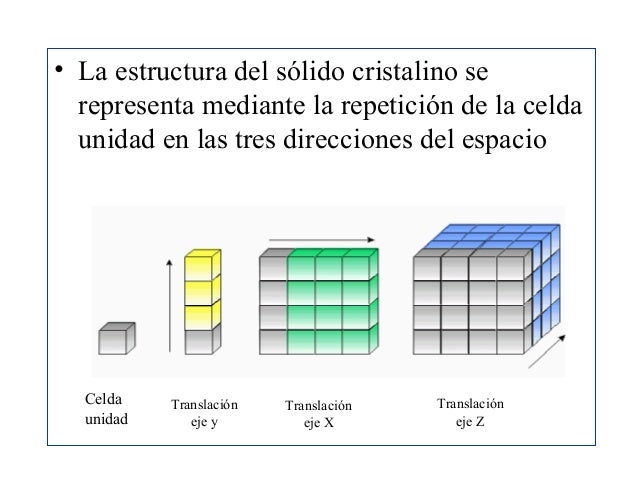
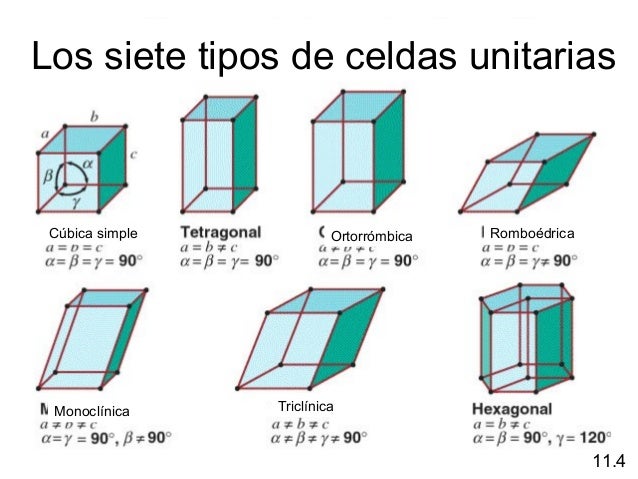
CELDAS UNITARIAS
orden y Desorden
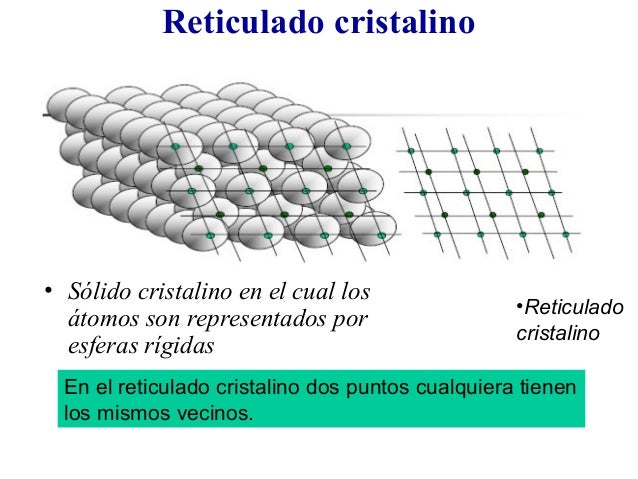
En los materiales cristalinos, las partículas componentes muestran un ordenamiento regular que da como resultado un patrón que se repite en las tres dimensiones del espacio, y a lo largo de muchas distancias atómicas. Los sólidos cristalinos poseen internamente un orden de largo alcance. La situación en un cristal es tal que el entorno de un determinado tipo de átomo siempre es el mismo (los mismos átomos vecinos y a idénticas distancias).
En los materiales amorfos, los átomos siguen un ordenamiento muy localizado, restringido a pocas distancias atómicas y que, por tanto, no se repite en las tres dimensiones del espacio. Se habla de un orden local o de corto alcance. En la siguiente figura se ilustran los conceptos de largo y corto alcance, en un esquema bidimensional.
 |
Ilustración de los conceptos: (izq.) de orden de largo alcance y (dcha.) de corto alcance. Obsérvese cómo en este último el orden sólo se restringe a ciertas zonas. Los puntos pueden representar un átomo, una molécula o un grupo de átomos o moléculas.
|
Aunque la mayor parte de los materiales metálicos son cristalinos en condiciones ordinarias, algunos de ellos se tornan amorfos cuando solidifican bruscamente a partir del estado líquido. Los materiales cerámicos pueden ser cristalinos (como el diamante), pero también pueden ser amorfos (como, por ejemplo, los vidrios de ventana). En general, la no cristalinidad en los cerámicos no exige velocidades de enfriamiento tan severas como en el caso de los metales, y puede obedecer a razones muy complejas. Los materiales moleculares suelen ser cristalinos, y los materiales poliméricos son inherentemente no cristalinos, aunque algunos de ellos pueden mostrar cierto grado de cristalinidad, nunca completo.
Una evidencia simple del carácter cristalino de algunos materiales es la propia forma externa de dichos materiales. Dicha forma a menudo sugiere que el material se ha construido adicionando bloques elementales idénticos, lo que delata un orden interno, algo que ya fue intuido por los mineralogistas del siglo XVIII. Por ejemplo, aunque no todas las caras de un cristal de cuarzo tienen la misma longitud, los ángulos que forman entre sí son exactamente iguales a 120º. Esto hace pensar que el bloque constructivo de ese cristal es hexagonal. La geometría interna de un cristal de cloruro sódico también queda evidenciada por su forma externa.. Nuevamente, el cristal no es un cubo perfecto, pero las caras son exactamente perpendiculares entre sí, lo que sugiere un bloque elemental cúbico.
ESTRUTURA COVALENTE
entre dos átomos se produce cuando estos átomos se unen, para alcanzar el octeto estable, compartiendo
electrones del último nivel
1 (excepto el Hidrógeno que alcanza la estabilidad cuando tiene 2 electrones). La diferencia de electronegatividad entre los átomos no es lo suficientemente grande como para que se produzca una unión de tipo iónica. Para que un enlace covalente se genere es necesario que la diferencia de electronegatividad entre átomos sea menor a 1,7.
De esta forma, los dos átomos comparten uno o más
pares electrónicos en un nuevo tipo de orbital, denominado
orbital molecular. Los enlaces covalentes se producen entre átomos de un mismo elemento no metal y entre distintos elementos no metales.
Cuando átomos distintos no metales se unen en forma covalente, uno de ellos resultará más electronegativo que el otro, por lo que tenderá a atraer la nube electrónica del enlace hacia su núcleo, generando un dipolo eléctrico. Esta polarización permite que las moléculas del mismo compuesto se atraigan entre sí por fuerzas electrostáticas de distinta intensidad.
Por el contrario, cuando átomos de un mismo elemento no metálico se unen covalentemente, su diferencia de electronegatividad es cero y no se crean dipolos. Las moléculas entre sí poseen prácticamente una atracción nula.
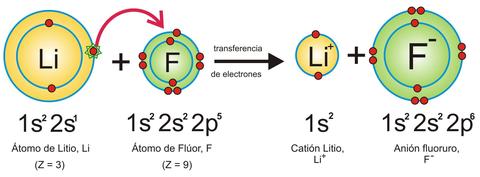
En síntesis, en un
enlace iónico, se produce la transferencia de electrones de un átomo a otro y en el enlace covalente, los electrones de enlace son compartidos por ambos átomos. En el enlace covalente, los dos átomos no metálicos comparten uno o más electrones, es decir, se unen a través de sus electrones en el último orbital, el cual depende del
número atómico en cuestión. Entre los dos átomos pueden compartirse uno, dos o tres pares de electrones, lo cual dará lugar a la formación de un enlace simple, doble o triple respectivamente. En la
estructura de Lewis, estos enlaces pueden representarse por una pequeña línea entre los átomos.